Сфероиды как перспективные модели для тестирования лекарственных препаратов
|
Работа призёра конкурса проектов и исследований «Наука для жизни» открытой городской научно-практической конференции «Наука для жизни» в секции «Биотехнологии. Молекулярная биология. Генетика» |
Направление работы: Биотехнология, Исследование лекарственных препаратов
Авторы работы: ГБОУ Школа № 1568
Email: Написать
Предметы: Биология
Классы: 10 класс
Мероприятия: Конкурс проектов и исследований «Наука для жизни» открытой городской научно-практической конференции «Наука для жизни» 2021 года
|
Актуальность
Разработка новых лекарственных препаратов и их тестирование – очень важный и длительный процесс. От начала выявления рабочих веществ до выдачи регистрационного удостоверения проходит обычно около 15 лет. Однако результаты, полученные при тестировании на монослое клеток, не всегда хорошо коррелируют с результатами клинических исследований, поскольку в 2D-структуре клетки почти не взаимодействуют между собой и с внеклеточным матриксом. В связи с этим всё большее распространение получают 3D-модели. Одной из таких моделей являются сфероиды – шарообразные агрегаты из клеток с максимальной плотностью упаковки. Из-за своей формы они идеально подходят для манипулирования. Сфероиды имеют сложную внутреннюю структуру, отражающую все виды межклеточных контактов, а также взаимодействие клеток с внеклеточным матриксом. Ещё одним важным свойством сфероидов является то, что они могут быть сформированы из разных видов клеток. Всё вышеперечисленное делает их удобной моделью для доклинических исследований лекарственных средств.
Цель
Демонстрация возможности использования сфероидов в качестве трёхмерной модели для тестирования лекарственных препаратов in vitro.
Задачи
- Фабрикация сфероидов из клеток линий HEK293 и Vero CCL-81 при различных первоначальных концентрациях клеток: 250, 500, 1000 и 2000 клеток на сфероид.
- Исследование зависимости диаметров сфероидов от первоначальной концентрации клеток и дня культивирования. Выбор первоначальной концентрации, обеспечивающей максимальную скорость пролиферации клеток в сфероидах.
- Фабрикация сфероидов с использованием выбранной первоначальной концентрации клеток. Посадка такого же количества клеток для культивирования в монослое. Обработка 1-суточных сфероидов и монослоя клеток противоопухолевыми препаратами цисплатином, докорубицином, фторурацилом и этопозидом на протяжении 72 часов.
- Оценка жизнеспособности клеток и сфероидов. Оценка количества мёртвых клеток в монослое и в сфероидах. Расчёт значений полумаксимальных ингибирующей (IC50) и цитотоксической (CC50) концентраций и их сравнение для двух клеточных линий и двух способов культивирования.
Оснащение и оборудование, использованное при создании работы
- Планшеты с низкоадгезивным покрытием
- Агарозные формы
Описание
Были сформированы сфероиды из клеток линий Vero CCL-81 и HEK293 при первоначальных концентрациях 250, 500, 1000 и 2000 клеток на сфероид, и изучена кинетика их роста на протяжении 7 дней. Обе клеточные линии через 24 часа образовали сфероиды правильной формы приблизительно одного размера в рамках одной концентрации. Дальнейшее наблюдение показало, что клетки обеих линий сохраняют способность к пролиферации в сфероидах.
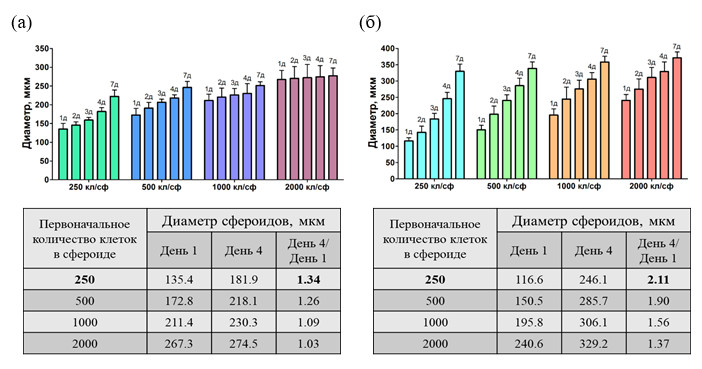
Кинетика роста сфероидов, сформированных из Vero CCL-81 (а) и HEK293 (б)
Для изучения влияния противоопухолевых препаратов на пролиферацию клеток Vero CCL-81 и HEK293 в 2D- (монослой) и 3D- (сфероиды) условиях культивирования было использовано три разных метода: с помощью резазурина, с помощью CellTiter-Glo 3D и путём измерения диаметров сфероидов.
Исследовали цитотоксичность 4 противоопухолевых препаратов: цисплатин, доксорубицин, этопозид и фторурацил.
Результаты работы/выводы
- Сформированы сфероиды из клеток линий Vero CCL-81 и HEK293 и изучена кинетика их роста. На основании полученных зависимостей диаметров сфероидов от первоначальной концентрации клеток подобрана концентрация, обеспечивающая максимальную скорость пролиферации клеток в сфероидах.
- Проведена оценка антипролиферативной и цитотоксической активности четырёх противоопухолевых препаратов цисплатина, доксорубицина, этопозида и фторурацила на клетках Vero CCL-81 и HEK293 в условиях 2D- и 3D-культивирования.
- Использовано три метода оценки жизнеспособности клеток. В зависимости от чувствительности методов предложены две схемы эксперимента, основанные на разных способах формирования сфероидов.
- Показано, что активность противоопухолевых препаратов зависит от способа культивирования клеток и от выбранной для теста клеточной линии.
- Полученные в работе результаты позволяют рекомендовать сфероиды в качестве трёхмерных моделей для оценки эффективности противоопухолевых препаратов. Предложенные методики формирования и анализа сфероидов могут быть использованы в дальнейшем для планирования экспериментов по тестированию препаратов на сфероидах.
- МФЦ – региональный инновационный продукт для повышения уровня жизни населения
- Сравнительный анализ содержания «живых» лактобактерий в молочных продуктах на примере йогуртов различных производителей
- Изучение состояния, распространения и степени риска исчезновения разных видов рода Пельтигера (Peltigera) в бассейне верхнего течения реки Зимёнки
- Выбор вида текстиля как одна из стратегий облегчения симптомов поллиноза при цветении растений
- Экономическая эффективность альтернативных источников энергии для теплоснабжения загородного дома
- Анализ уровня экологической грамотности и интереса общества к вопросам экологии в разных возрастных группах и создание экологического информационно-просветительского сайта
- Изучение болезней деревьев Терлецкого лесопарка
- Разработка модели анализатора воздуха с бактерицидной рециркуляцией
- Зависимость окраски богомолов Hierodula membranacea на ранних стадиях развития от условий окружающей среды в неволе
- Изучение эффективности и сравнительная характеристика глинистых материалов, предназначенных для очистки воды и поверхностей конструктивных материалов от радиоактивных загрязнений
- Краудфинансирование как инновационный способ получения дополнительного дохода
- Центральные банки и их роль на примере Центрального банка России
- Влияние экологичных брендов на выбор потребителя
- Влияние бренда на поведение потребителей
- Проблемы ИТ-менеджмента и пути их решения
- Влияние коронавируса на предпочтения потребителей
- Converting polyethylene plastic into fuel under laboratory conditions. Myth or reality? / Топливо из полиэтилена в лабораторных условиях. Миф или реальность?
- Как продлить жизнь цветка?
- Биоразлагаемая одноразовая посуда из фруктово-овощного сырья
- Целесообразность перевода или адаптация названий иностранных брендов для успешного маркетинга
- Анализ влияния химических способов сохранения товарного вида фруктов на их качество и внешний вид
- Изучение распространения и состояния популяций редких и исчезающих видов цветковых растений в бассейне верхнего течения реки Зимёнки
- Показатели чистоты рук при использовании моющих средств
- Эффективность методов эмоциональной регуляции при борьбе с математической тревожностью
- Исследование эффективности энтеросорбентов при отравлении
- Насилие в семье как социальная проблема
- Позитивная дискриминация в зарубежных странах и её проявление в России
- Проект Arduino. Система автоматического освещения с датчиком движения
- Анализ осведомлённости представителей разных поколений о положениях гендерной теории
- Взаимосвязь шахмат с математикой
- Молодежные субкультуры как социально-философский феномен (на примере готов)
- Комплекс выявления неправомерной парковки транспортных средств
- ПДД VR
- Виртуальный мебельный магазин
- Интернет-сервис для анализа информационной повестки
- Тим-ка
- «Умная» урна
- «Умные» весы для работы в условиях морской качки на научных судах
- Стенд для испытания научных приборов в воссозданных условиях морской качки
- Многофункциональный светильник с дистанционным выбором режима работы
- Инновационный метод борьбы с синантропной флорой транспортных путей на примере борщевика Сосновского с помощью растений-ремедиаторов
- Влияние противогололёдных реагентов на окружающую среду
- Влияние проветривания на качество воздуха в школе и дома
- Анализ хлебных изделий и поиск оптимального экологически безопасного состава продукции, способствующего сохранению здоровья населения
- Методы получения новых материалов на основе пероксидных соединений олова
- Создание пандусов нового поколения и выкатного устройства городского транспорта для людей с ограниченными возможностями на основе актуаторов
- Уничтожение культурных ценностей как метод ведения войны в международном праве
- Мобильное приложение «Космос»
- Автономная система защиты от утечки газа
- Создание ультразвукового увлажнителя для оптимизации параметра влажности городских квартир
- Bio-Hatchery Helper
- Совершенствование логистики и улучшение контроля за передвижением поездов Российской Федерации с целью увеличения пропускной способности железной дороги
- Анализ зависимости развития розничных продовольственных торговых сетей и доходов населения в федеральных округах РФ на примере ЦФО, СФО, СКФО и ДФО за 2019–2021 гг.
- Оценка токсичности домашних бытовых средств для мытья посуды методом биотестирования
- Грибы-дереворазрушители на спилах лесообразующих древесных пород звенигородской биологической станции МГУ им. С.Н. Скадовского
- Использование природных соединений на основе препаратов забруса и перца в отношении плесени с закреплением действующих веществ
- Получение и изучение новых антипиренов, модифицированных нано-TiO2∙nH2O
- Проблемы ИТ-менеджмента и пути их решения
- Проблемы наследования земель сельскохозяйственного назначения
- Решение простейших геометрических задач и построение их чертежей с опорой на текстовые задания низкой сложности
- Создание мобильного приложения «BookSharing» для поддержки городской системы книгообмена
- Экономическая и политическая ситуация в Европе перед началом Второй мировой войны. Возможно ли было предотвратить вооружённый конфликт? Как использовать полученный исторический опыт на практике
- Исследование изменения отношения россиян к рождаемости в Российской Федерации во время пандемии
- Факторы и тенденции производительности труда: Россия и страны ЕС
- EYE SAFETY 2.0
- Установка для переработки углекислого газа
- Марикультура как симбиоз человека и природы
- Исследование влияния автомобильного транспорта на содержание тяжелых металлов в почве и выработка рекомендаций по снижению негативного воздействия
- Синтез и строение координационных соединений никеля(II) c атомами диспрозия(III) и анионами замещенных малоновых кислот
- Разработка методики сравнения антиоксидантной активности эфирных масел сосны и апельсина
- Соловецкий лагерь особого назначения: основные этапы развития, организация труда и быт заключённых
- Роль цифровых технологий в деятельности микропредприятий и самозанятых
- Разработка интерактивного сайта для управления ботом и разработка умного ассистента
- Основные этапы проектирования, разработки и реализации шлифовального станка с использованием 3D-моделирования
- Виртуальная реальность как инновационная образовательная технология
- Фильтрация микрочастиц полиэтилена
- Разработка конденсационного колодца для получения воды из атмосферного воздуха с применением композиционных материалов
- Использование современных технологий по утилизации снежного покрова территорий урбанизации с целью улучшения экологической обстановки в городах России
- Новые железосодержащие материалы для очистки воды
- Исследование морфологических, поверхностных и биологических характеристик губок на основе поликапролактона
- Советский журнал «Крокодил» как исторический источник
- Настольная игра «От Рюрика до Путина»
- Автоматический дозатор лекарств
- Эффективное обучение управлению самолётом с использованием технологий виртуальной реальности
- Разработка виртуальной галереи импрессионистов с использованием технологий виртуальной реальности
- Создание модели имплантируемого насоса вспомогательного кровообращения с беспроводным энергообеспечением
- Велосипедный поворотник
- Развивающая интерактивная игра для детей дошкольного и младшего школьного возраста «Новогодние приключения»
- Новое применение QR-кода. QR-код – прошлое или будущее?
- Анализ минимального размера оплаты труда и последствия его повышения в России
- Электродинамическое моделирование сверхширокополосного излучателя с использованием импедансносогласованного материала
- Топическая приуроченность папоротников Приморского края и потенциал их использования в озеленении
- Исследование жесткости воды при помощи устройства на платформе Arduino
- Исследование эдафических факторов гибели саженцев сосны обыкновенной в Парке Дружбы
- Методический 3D-конструктор «Сириус» для слепых и слабовидящих
- Особенности развития эмоционального интеллекта и формирования самоотношения у подростков и связь между ними
- Купол церкви из композитных материалов
- Создание универсального средства для выведения пятен от травы на одежде
- Методика перекрёстного обучения в средней школе на примере разработки проекта «Космический полигон»
- Приключение Алисы – царство абсурда или ключ к тайнам познания?
- Знаменитые улицы района Хорошёво-Мнёвники
- Модификация для игры Minecraft
- Автоматическая система ячеек для хранения личных вещей
- Универсальный контроллер для теплицы
- Повышение благосостояния за счет инвестирования в фондовый рынок
- Анализ мошеннических действий по отношению к финансовым активам физических лиц
- От банковского депозита к фондовому рынку: выбор инструментов для инвестирования денежных средств в новых условиях
- «Умный» свет
- Автоматическая кормушка для рыб
- Датчик СО2
- Popsicle skateboard with an electronic kit made of ultralight composite materials / Модель скейтборда «Эскимо» с электронным набором, выполненная из сверхлëгких композиционных материалов
- Оценка экологического состояния Новомосковского административного округа на примере поселения Московский
- Изучение видового состава эпифитных лишайников городского округа Серпухов в целях выявления эффективных биоиндикаторов и разработки методики оценки состояния окружающей среды с их помощью
- Galleria mellonella как новое оружие в борьбе с пластиком. Сравнение динамики развития вида на разном корме
- Консонантное письмо как способ оптимизации речи в русском языке
- Литературный подкаст о творчестве Виктории Токаревой
- Исследование концентрации углекислого газа в помещениях
- Определение применимости лазерных и аддитивных технологий при изготовлении музыкальных инструментов
- Особенности детско-родительских отношений и склонность к интернет-зависимости в подростковом возрасте
- Изучение восприятия COVID-19 подростками в условиях пандемии на основе графосемантического моделирования
- Страх неоправданных ожиданий и страх пробовать что-то новое у подростков 15–17 лет
- Кто живет на овощах и фруктах
- Изучение коллоидно-химических характеристик смесей ПАВ, содержащихся в бомбочке для ванн
- План для идеальной организации конкурса по спортивно-бальным танцам
- Коммеморация исторической памяти Великой Отечественной войны на примере Республики Казахстан (анализ государственных списков памятников истории и культуры в Республике Казахстан)
- Моя история фотошопа. Обучение и работа в сфере дизайна
- Символьный шифратор
- Макет онагра с системой управления голосовыми командами
- Программный анализ покупательской корзины и транзакций с целью выявления ассоциативных связей между товарами
- Сравнение эффективности катушек индуктивности разных форм для беспроводной передачи энергии имплантируемым медицинским устройствам
- IoT метеостанция
- Исследование влияния концентрации углекислого газа в помещениях школы на самочувствие обучающихся
- Выгоды и издержки Олимпийских игр
- Особенности продвижения предприятий общественного питания в российской и мировой практике
- Эволюция транснационального сотрудничества России и стран арабского мира (на примере региона Персидского залива)
- Видеоэкология. Район будущего. Архитектурная модель / Videoecology. District of tomorrow. Architectural model
- Биоиндикация сапробности качества пресных вод национального парка «Смольный»
- Экология в настольных играх: изучаем играя
- Популяция можжевельника обыкновенного (Juniperus communis) в бассейне левобережья реки Зимёнки: распространение, состояние, факторы риска исчезновения
- Откуда берутся слова. Этимология неологизмов
- Трудности перевода русской классической поэзии на иностранные языки на примере сравнительного анализа переводов стихотворения М.Ю. Лермонтова «Смерть поэта» на английский, испанский и итальянский языки
- Исследование влияния плотности популяции на репродуктивные способности дрозофилы
- Создание прибора для измерения гипермобильности мизинца, а также локтевого и коленного суставов
- Изучение уровня внушаемости среди учеников младшей и средней школы
- Роль сюжетно-ролевой игры в развитии детей с ОНР
- Интернет-зависимость в подростковом возрасте
- Исследование вольфрамат-фосфатов натрия-лютеция и натрия-гадолиния
- Создание спрея на основе экстракта перца рода Capsicum для предотвращения появления плесени
- Великая Отечественная война
- Сравнительный анализ пероксидазной активности образцов чая как критерий оценивания их качества
- Арктика: ты чья?
- Картографирование железнодорожного транспорта в районе города Якутска
- Анализ озеленённости города Москвы
- Бесконтактный термометр в турникетах транспортных предприятий и общественных организаций
- Изучение роли гена Brain tumor (brat) в развитии пролиферативных заболеваний головного мозга
- Сравнение концентрации каротиноидов в моркови и рыбе семейства лососёвых
- Полиморфизм гена МС1R
- Создание мобильного приложения «Student Assistant» для помощи учащимся в организации учебного процесса
- Лазерный станок с числовым программным управлением
- Программно-аппаратный комплекс автоматизации открывания дверей
- Сравнение геномов Escherichia coli с разным набором антигенов
- Влияние миелотоксического агранулоцитоза на течение коронавирусной инфекции у больных онкогематологического профиля
- Изучение гена FRIGIDA-LIKE в видах BRASSICA
- Изучение процессов замедления развития и облегчения течения болезни Альцгеймера с помощью интеллектуальной активности на модели D.melanogaster
- Создание сайта для повышения уровня финансовой грамотности населения
- Анализ возможности введения безусловного базового дохода на территории Российской Федерации
- Информационная финансовая безопасность при денежных переводах
- Микромир пыльцы
- Изучение концентрации и характеристик внеклеточной ДНК как маркера преэклампсии и гестационной артериальной гипертензии на ранних стадиях беременности
- Получение протопластов BRASSICA NAPUS для геномного редактирования
- Коптерная разведка тлеющих торфяных очагов с сенсорами на основе нано-SnO2
- Влияние твёрдого комбинированного противогололёдного реагента на ранние этапы онтогенеза злаковых растений
- В защиту бездомных животных
- Просто о сложном: «Влияние работы лимфатической системы человека на поведение людей в разное время года»
- Проектирование научной арктической станции на основе национального парка «Русская Арктика»
- Паспорт исследователя природного и культурного наследия как инструмент популяризации всемирного достояния
- Особенности строительства и расположения Нового шёлкового пути
- Система обеспечения безопасности от обледенений
- Автоматизированная система выращивания растений «Smart greenhouse» с голосовым ассистентом
- «Умная» кружка – помощник современного человека
- Влияние постороннего объекта на активацию сенсомоторных ритмов ЭЭГ
- Нарушения сна и степень тревожности у студентов-медиков, проживающих в общежитии или с родителями
- Изучение влияния соматосенсорной компоненты на качество представления движений для тренировок сенсомоторных навыков в киберспорте
- Организация по выносу и сортировке бытовых отходов
- Спасение людей
- Разработка подходов к синтезу двухпалубных гетеролептических комплексов натрия(III) с тетра-15-краун-5-октабутоксиоксантреноцианом
- Численное моделирование излучения сверхкороткого импульса для радиолокации
- Влияние нитратов на организм улиток
- Разработка технологии получения мази против кожных заболеваний
- Получение эмульсии методом температурной инверсии фаз
- Цифровая грамотность: отличается ли уровень наших одноклассников от общего уровня российских подростков
- Влияние информации о наличии ГМО на намерение купить колбасное изделие
- История, проблемы и перспективы развития дипломатических отношений между Россией и Японией
- Синтез и исследование оптических свойств изомеров N’-хинолин-6-ил-N,N-бис[2-(хинолин-6-иламино)этил]этан-1,2-диамина и N’-хинолин-3-ил-N,N-бис[2-(хинолин-3-иламино)этил]этан-1,2-диамина
- Синтез эпоксиизоиндолов и изучение их противовирусной активности
- Синтез замещенной пиразолкарбоновой кислоты
- Синтез и исследование детектирующей способности нового флуоресцентного детектора на основе линейного и разветвленного полиамина
- Новые синтетические производные кофермента SAM для изучения структуры метилтрансфераз
- Индикаторная система на основе наночастиц диоксида церия
- Антибактериальное покрытие на алюминии
- Получение пленок на основе оксида графена, содержащих катионы металлов
- Модификация катодов LiFePO4 для литий-ионных аккумуляторов путем введения углеродных наноматериалов
- Создание, разработка технологии изготовления антибактериального пластыря на гидроколлоидной основе с использованием наночастиц серебра
- Сравнительный анализ различных видов масел для использования их в качестве машинного масла
- Беспилотный летательный аппарат и система управления им, основанная на Arduino
- Робот-исследователь для видеоинспекции труднодоступных мест
- Графическое использование фрактальных структур в программировании
- Диаграмма Вороного высшего порядка на различных сетках, на плоскости и в пространстве
- Использование уравнений плоских кривых при разработке дизайна предметов интерьера
- Поиск геодезических линий на Архимедовых телах
- Специальные плитки Брайля для изучения алфавита незрячими
- Система для ориентации в пространстве и повышения мобильности слабовидящих
- Онлайн-мониторинг состояния домашних питомцев по параметрам физической активности
- Влияние ионов железа Fe3+ на рост и продуктивность томата
- Изучение работы иммунохроматических тест-систем на примерах тест-систем «АИН SARS-CoV-2 CoronaPass» и тест-систем для выявления вирусных заболеваний картофеля (X-, Y-, S-, M-, ВСЛК)
- Получение домашнего квасного сусла. Качественно-сравнительный анализ с производственным аналогом
- Суперконденсатор и области его применения
- Генератор дома. Двигатель Стирлинга
- Подбор физико-химических условий для повышения КПД микробного топливного элемента – перспективного источника энергии на предприятиях
- Система безопасного освещения лестничных пролётов
- Цифровая образовательная биржа как бизнес
- Создание и продвижение сборника рассказов и стихотворений на основе применения цифровых технологий и формирования контента, мотивирующего к чтению (на двух языках)
- Разработка прототипа кобуры для страйкбольного пистолета GLOCK
- Синтез и исследование противогрибковых свойств наночастиц ZnO с этосомным покрытием
- Исследование взаимосвязи перфекционизма и формирования системы ценностей учащихся 10-х классов
- Исследование магнитного трения
- Модуль забора грунта
- Буктрейлер как средство привлечения внимания к чтению классической литературы
- Исследование эмпоронимов района Орехово-Борисово Южное
- Электронный тематический словарь «Фразеоландия»
- Суеверия в русской и американской культурах
- «Своевольные смыслы», или Микроисторическое исследование лексики XIX–XXI веков на материале НКРЯ»
- Инвалидная коляска с функцией спуска и подъема по лестнице
- Изучение Шагающих механизмов
- Голографическая призма
- Распространение лазерного излучения в оптически неоднородных жидких средах на примере явления «Фата-моргана»
- Разнообразие мутаций дрозофилы
- Сфероиды как перспективные модели для тестирования лекарственных препаратов
- Разнообразие гена LFY и антиоксидантов в культурных видах Brassica
- Влияние нейрональной пластичности, опосредованной цитоплазматическим полиаденилированием, на способность самцов мух дрозофил к восприятию новой информации. Вклад группового содержания животных
- Возможности химиотерапии: синтез цитостатических соединений платины
- Синтез новых гетерометаллических (3d, s) фуроатных комплексов с n-донорными лигандами, исследование строения и биологических свойств
- Влияние витамина С на здоровье человека и воздействие экологических факторов на изменение его содержания в продуктах питания
- 3D-левитрон – установка для создания стоячих звуковых волн
- Влияние гравитационной силы на выживаемость клеток млекопитающих
- Создание модели спутника стандарта «CUBESAT»
- Проектирование механизма развёртки солнечной батареи спутника Земли на основе оригами
- Рефлектор зеркальных космических антенн межспутниковой связи из композиционных материалов
- Популяционно-генетический анализ высокомолекулярных глютенинов яровой тритикале сорта Тимирязевская 42
- Корректировка использования луговых угодий и летнего питания коров на основе оценки кормовых качеств сенокоса и пастбища
- Опыт выращивания зелени на установках аквапоники в школьной оранжерее
- Влияние искусственного света на рост растений
- Влияние почв из разных источников на всхожесть и морфологические характеристики растений
- Сравнительная характеристика качества мёда частных фермерских хозяйств с мёдом из сетевых супермаркетов с использованием методик ветеринарно-санитарной экспертизы
- Изучение особенностей выращивания растений для развития сити-фермерства
- Изучение влияния музыки различных жанров на прорастание семян и развитие проростков растений
- Влияние аллельного состава генов запасных белков яровой тритикале на технологические качества зерна
- Экспериментальная гидропонная установка для выявления оптимального питательного состава для растений на определённой стадии развития
- Создание и обслуживание удобной в эксплуатации в городских условиях установки для выращивания агрокультур с использованием гидропонной системы
- Эндуро мотоцикл
- Intelligent system of collecting and sorting rubbish Master Bin 20.2.0
- Малая метеорологическая ракета «ММР-548»
- Морфологический анализ структуры лёгкого в экспериментальной модели эндотоксического воздействия липополисахарида (инфекционно-токсический шок) на дыхательную систему крысы
- Разработка состава и технологии получения шипучей таблетки с экстрактом черники
- Применение стопошагающих механизмов конструкции П. Чебышева в условиях современного производства
- Разработка прототипа устройства для тестирования программ управления автономным полётом беспилотного летательного аппарата
- Разработка датчиков и вибромоторчиков, встроенных в смоделированную под них одежду
- Синтез субклеточно-нацеленных фотосенсибилизаторов
- Получение экологически чистых солнечных батарей на основе природных пигментов
- Расчёт параметров пучка когерентного излучения при его генерации и распространении через бирезонаторную оптическую систему
- Хранение медикаментов для людей с хроническими заболеваниями
- Терморасширенный графит, модифицированный соединениями различных металлов
- Исследование цитотоксического действия солнечных очков
- Анализ облачного покрова Венеры
- Разработка метода визуализации эпигенетических ландшафтов
- Влияние уборки опада с газонов г. Москвы на скорость разрушения целлюлозы в почве
- Исследование гемолитической активности антимикробных пептидов
- Исследование электрических свойств карандашных линий
- Картина мира Стивена Кинга и инструменты её формирования (на примере романа «Мёртвая зона» – «The dead zone»)
- Стартап по созданию ивент-сервиса
- Союз оригами и геометрии
- Разработка ассистивного средства реабилитации, направленного на помощь незрячим и слабовидящим
- Новый законопроект об ответственном обращении с животными
- Интерактивный квест «День города Москвы»
- Какие условия необходимы для того, чтобы успешно изучать два иностранных языка одновременно?
- Специальное рабочее место
- Разработка приложения для изучения физики в VR
- Количественная оценка полезности интеграционных объединений для государств Шанхайской организации сотрудничества
- Создание медных наноструктурированных сенсоров для амперметрического определения глюкозы в водных растворах
- Создание программного модуля для иллюстрации эмпирических распределений
- Бизнес-план «Франшиза образовательного IQ Центра»
- Заграница нам поможет? Сравнительный анализ содержания органических веществ в ягодах асаи и чёрной смородины
- Изучение процессов старения, ассоциированных с голоданием, у мышей
- Индикатор срока годности
- Депрессивное состояние в подростковом возрасте
- Москва – Дом Пресвятой Богородицы
- Корневые системы липы мелколистной и тополя бальзамического в условиях Московского промышленного центра
- Зарядная станция на базе элемента Пельтье
- Новые синтетические производные кофермента SAM для изучения структуры и функций метилтрансфераз методами спектроскопии ЯМР
- Влияние физико-химических факторов на белки-аллергены сои и чечевицы
- Пособие по ведению домашнего хозяйства «Азбука домохозяйки»
- Робот-экскурсовод
- Робот-официант
- Разработка аналога ксероформа на основе нанокристаллического диоксида церия
- Сравнение мультиспиральной и конусно-лучевой компьютерной томографии
- Уловки маркетологов
- Состав флоры участка «Шопинская степь» Белгородского района Белгородской области
- Создание медиапортала «Ostrov.press»
- QuasiCube project
- AR Sketchpad 2.0
- Приют для животных
- Интерактивный сайт спортивной секции
- Синтез мезопористых частиц кремнезёма на матрице мицелл мирамистина
- CRISPR/Cas9 для получения гипоаллергенных кошек
- Разработка метода получения витаминов группы B с помощью азотфиксирующих бактерий: Azotobacter chroococcum и Beijerinckia fluminensis
- Исследование возможности получения прекурсоров замещенных кобальтатов - катализаторов важнейших промышленных процессов
- Сегрегация комплекса Jaera albifrons в акватории острова Ряжков
- Исследование ингибирующего влияния ряда фосфоротиатных олигонуклеотидов на активность теломеразы в лизатах опухолевых клеток MCF-7 in vitro
- Синтез и исследование свойств ортотанталата и ортониобата Европия
- Регенерация протопластов мутантного растения мха
- Система позиционирования
- Разработка синтетических подходов к разделению диспироиндолинонов на стереоизомеры
- Синтез и строение полимеров 3d-металлов (CuII, CoII, MnII) с анионами аллил- и циннамилиденмалоновой кислот и мостиковыми N-донорными лигандами
- Синтез двойных ортофосфатов и ортованадатов гадолиния и исследование их свойств
- Наночастицы берлинской лазури – красивый пигмент и «умный» катализатор
- 3D-модели всех типов солнечных часов
- Дендриты меди: реализация принципа самоподобия в природе
- Влияние тяжёлых металлов на рост и развитие культурных растений на примере тритикале
- Инстинкт симпатичного незнакомца
- Наиболее эффективные способы определения лжи по внешним признакам среди подростков (мимика, жесты, речь)
- Создание герметика для герметизации ввода кабельного пучка
- Моделирование миража в оптически неоднородной среде
- Анализ причин притока частных инвесторов на фондовый рынок
- Генератор рельефа местности
- «Умный» дневник
- Когнитивно-контрастивное исследование фразеологизмов, обозначающих черты характера и поведение человека в русском и английском языках
- Создание смесей на основе ПАВ для улучшения смачивания гидрофобных поверхностей
- Глобальный вызов просвещению: образовательная социальная сеть «Sphera»
- Анализ сортов томатов по устойчивости к вирусу томатной мозаики
- Школьная корпорация
- Получение нетканых материалов из поливинилпирролидона методом электроформования
- Модификация внутренней поверхности металлических труб с целью улучшения эксплуатационных характеристик
- Поиск новых каталитических систем для аддитивной полимеризации норборнена
- Биоразнообразие фитоценоза зоны литорали острова Ряжков
- Подростковая конформность как фактор принятия решения о прививке от гриппа
- Феминитивы в русском и английском: временное явление моды или необходимая структурная единица языка?
- Получение обратной эмульсии с инкапсулированным ниацинамидом
- Поиск новых генов и регуляторных механизмов, отвечающих за формирование и поддержание статуса предшественников половых клеток Drosophila melanogaster
- Синтез новых гетерометаллических (3d, s) фуроатных комплексов с n-донорными лигандами, исследование строения и биологических свойств
- Зависимость энергетической эффективности ветрогенераторов от конфигурации их лопастей
- Синтез и противотуберкулёзная активность новых фуроатных комплексов кобальта (II) и цинка
- Разработка противоопухолевого агента с прооксидантным действием
- Личная финансовая безопасность: проблемы и пути решения
- Система обработки видеопотока и данных положения в пространстве «ARGUS»
- Бактериальные кишечные комплексы почвенной мезофауны г. Москвы
- «Мы смотрим на звёзды, или звёзды смотрят на нас?»
- Синтез и строение координационных полимеров переходных металлов с анионами замещённых малоновых кислот и мостиковыми N-донорными лигандами
- Изучение фосфолипидного состава метилотрофных бактерий методом тонкослойной хроматографии
- Оптимизация метода FISH на бактериях
- Экскурсионный 3D-маршрут по корпусу института тонких химических технологий Российского технологического университета МИРЭА с использованием VR-технологий
- Организация медицинской службы Красной Армии в годы Великой Отечественной войны. Разработка экспозиции музея Северного флота и экскурсии
- Получение натурального корригента запаха для дезинфектанта в форме спрея
- Экологичность продуктов питания и безопасность для человека. Наличие ветеринарных лекарственных препаратов в яйцах
- Влияние буферных агентов на процесс меднения
- Получение и исследование на биоактивность ацилгидразинов нитрофуранового ряда
- Создание модели портативного пресса для пластиковых стаканчиков с целью эффективного раздельного сбора ТКО на территории ГБОУ Школа № 97 г. Москвы
- Исследование и создание фигур по стереометрии с применением 3D-технологий и аддитивных технологий
- The best way to preserve vitamins in food / Определение оптимального метода консервирования для сохранения витаминов в продуктах питания
- Изучение влияния ионов алюминия на проростки новых сортов озимой тритикале селекции РГАУ МСХА имени К.А. Тимирязева
- Влияние состава культуральной среды на каллусогенез подсолнечника в культуре in vitro
- Аудиторская проверка на примере предприятия ООО «АкваПрофиль»
- Расширение базы микропрепаратов по зоологии в школьном кабинете биологии
- Каталитический крекинг полиэтиленовых отходов
- Капсула жизни
- Бизнес-планирование. Финансовый план – основа предпринимательской деятельности
- Экологическое состояние южных ландшафтов парка «Зарядье»
- Художественное пространство романа Рэя Брэдбери «Вино из одуванчиков»
- Сравнение методов аппроксимации данных путём минимизации функций невязки различных видов
- Разработка автоматизированной системы полива комнатных растений
- Прибор для отслеживания уровня радиации и концентрации опасных для человека газов
- Определение сапробности участка Москвы-реки в районе Звенигородской биостанции МГУ и в районе Братеево Южного административного округа г. Москвы
- Морфология кривых блеска рентгеновских новых
- Влияние биоразлагаемости опада на обилие грибов
- Разнообразие гена FRI у растений семейства Brassicaceae
- Синтез металл-органических координационных полимеров из предорганизованных гетерометаллических {ZnEu} блоков
- Создание адгезионных матриц для трансдермального введения лекарственных средств
- Термокаталитический крекинг отходов полистирола для получения ценных продуктов
- Создание и исследование характеристик намагничивающего устройства
- Влияние режима сна на развитие тревожности и успеваемость учащихся подросткового возраста
- Каталитический крекинг отработанного масла для получения бензина и сырья для нефтехимии
- Инвестиционный проект в российской нефтегазовой отрасли: экономические, социальные и экологические факторы
- Возможности образовательной платформы МЭШ при проведении практических работ в профильных медицинских классах и в классах с углублённым изучением биологии
- Модный приговор для аллергиков
- Влияние химического состава отработанных батареек на рост и развитие растений
- Определение ионного состава водных растворов с помощью лазерной спектроскопии комбинационного рассеяния и метода искусственных нейронных сетей
- Аппаратно-программный комплекс управления теплицей «Теплица XXI века»
- Создание сборника омофонов для упрощённого изучения английского
- Автоматическая система управления светом (АСУС)
- Радиоуправляемое судно для очистки водоёмов
- GreenBox (умная теплица)
- Создание растений-биосенсоров на тяжёлые металлы
- Генетический анализ активности мобильного генетического элемента на модельном объекте Drosophila melanogaster
- Внедрение альтернативных источников энергии на примере метрополитена
- Онлайн-переводчики – помощники или враги?
- Оценка засорённости овсяного и картофельного полей в Переславском районе Ярославской области в свете борьбы с сорняками
- Исследование влияния морфологических характеристик на механические свойства высокопористых материалов на основе полилактида для регенеративной медицины
- Интернет-магазин «EXMA»
- Выделение почвенных штаммов азотофиксирующих бактерий и применение их в сельском хозяйстве в качестве биоудобрений
- Изучение экологии городских почв на примере почв территории природного сквера
- Визуализация контролируемых элементов содержания (КЭС) школьных предметов
- Влияние гипоксии на морфологию нервных клеток
- Разработка онлайн-сообщества по продуктивной подготовке к предпрофессиональному экзамену по биологии
- Эффекты фокусировки атомов при эмиссии с поверхности монокристаллов
- Создание аудиогида по Москве
- Робот Зевс
- Разработка сорбента для аффинной хроматографии на основе пептидомиметиков
- Моделирование роликовых однорядных цепных передач в системе автоматизированного проектирования T-FLEX CAD
- Контекстная реклама как PR-инструмент привлечения абитуриентов в вузы в условиях нового поколения Z
- Качественный и количественный анализ пастеризованного молока современных производителей
- Logobot – логопедический web-тренажёр
- Каталог проектных и исследовательских работ участников, победителей и призеров открытых городских научно-практических конференций 2019 года
- Селективное восстановление нитросоединений в присутствии пентакарбонила железа в качестве восстановителя
- Исследование белка WBSCR2
- Синтез и строение комплексов d-металлов с анионами ферроценкарбоновых кислот
- Раскрытие фторированных циклопропиламинов как новый подход к синтезу функционализированных фторалкенов
- Новая реакция присоединения эфиров азодикарбоксилатов к 8-гидроксихинолину – метод получения производных хинолинов с потенциальной анти-ВИЧ активностью
- Pd-катализируемое аминирование в синтезе новых флуоресцентных сенсоров, содержащих фрагменты 2,2’-диаминобинафталина, диазакраун-эфира и диаминокаликсарена
- Синтез и строение полимеров меди(II) и марганца(II) с анионами аллилмалоновой кислоты и 1,2-бис-(4-пиридил)этиленом
- Разработка методики синтеза гетерометаллических комплексов железа и f-элементов
- Оценка значимости воздействия государственного регулятора на динамику курсов основных резервных валют в 2018 году
- Разработка и синтез лантанидных меток, основанных на производных диэтилентриаминпентауксусной кислоты
- Дифракционная картина на мазке крови
- Физическая модель детектора газов на основе графена
- Эффективность запоминания аффективно окрашенных слов в разных эмоциональных состояниях
- Экономическое чудо Китая
- Система расширения функционала карты прохода и питания, или Просто Lectio
- Социальные инновации как способ преодоления социального неравенства в отношении здоровья (на примере сахарного диабета)
- Автоматизация полива: качество выше при меньших издержках
- Технология создания искусственных почв с применением почвенных модификаторов
- Исследование эффективности моющих средств и их влияние на организм человека
- Регистрация и обработка биопотенциалов в задачах управления кибернетическими устройствами
- География на easy
- Персонифицированная упаковка на основе трековых мембран для продуктов питания. Моделирование газодинамической системы
- Влияние состава культуральной среды на ростовые параметры картофеля при клональном микроразмножении сорта Ред Скарлетт
- Восстановление двигательной активности медицинской пиявки в искусственных условиях
- Изучение влияния антимикробных пептидов на антибиотики при их совместном применении
- Проблема загрязнения почв остатками гербицидов
- Подбор оптимального состава реакционной смеси для бесклеточного биосинтеза белка
- Искусственные экосистемы. Роль в передаче инфекционных заболеваний на примере болезни легионеров
- Сравнительная антропотолерантность различных цветовых морф сизого голубя
- Биологическое производство растительных волокон с заданными физико-химическими свойствами
- Исследование влияния микроструктуры на свойства новой корпусной стали ядерных реакторов
- Выявление характерных витаминов для видов растительного молока
- Выбор и оптимизация условий ОТ/ПЦР для высокоэффективного анализа уровня экспрессии мРНК гена c-Myc
- Практическая работа по географии: выращивание кристаллов галита
- Бизнес-план
- Образовательный туризм как альтернатива классическому школьному образованию
- Наблюдение фотосферы Солнца в астрокосмическом комплексе имени Сергея Павловича Королёва с использованием АВР-3 ИФТИС
- Бизнес-план. Создание фотостудии
- Создание обучающей игры о Кандалакшском районе Мурманской области
- Современные способы экономии при помощи мобильных приложений и сети Internet
- Комплекс автономного функционирования коптеров
- Газированная вода – яд малыми дозами
- Влияние видеоигр на человека
- Средство передвижения для людей с ограниченными возможностями с функцией мониторинга сердечно-сосудистой системы и дистанционным управлением
- Определение оптимального способа консервирования для сохранения витаминов в продуктах питания
- Иммобилизованный фотопереключаемый флуоресцентный белок как основа для носителя информации
- Создание учебно-познавательной тропы «Ландшафты родного края»
- РОБОТ «ГОР» для дистанционного осуществления погрузочно-разгрузочных работ
- Нейронные сети. Машинное зрение
- Умные пептиды
- Разработка контента в социальных сетях для подготовки к устной части ОГЭ по английскому языку
- Оптимизация современной парковочной системы
- Изучение суточных колебаний плотности потока радона с поверхности грунта
- Проблема высадки космических аппаратов на другие планеты
- Робот-сапер: Zirk 5
- Изучение перекрёстной реактивности специфических IgE к пищевым аллергенам класса LTP
- Бизнес-план открытия кофе-точки
- Адаптивная система экономии электроэнергии
- Функциональные лазерные материалы нового поколения
- Создание экспериментальной установки для исследования физического взаимодействия жидкой и газообразной сред
- Разработка прикладного программного обеспечения для тестирования экспериментальных структур сверхпроводник-изолятор-сверхпроводник (SIS-переходов)
- Разработка действующей модели турбореактивного двигателя с осевым компрессором
- Магнитная левитация высокотемпературного сверхпроводника
- История слова «прелесть» в русском языке (XVIII−XXI вв.)
- Агроэкологические основы выращивания селекционного картофеля
- Световой будильник
- Разработка автоматизированной системы управления мини-теплицей
- Исследование связи толщин годичных колец ели и климатических условий в средней полосе России
- Подмосковье − родина акул
- Сравнение влияния нескольких типов засоления на клеточные компартменты двух сортов томата
- Специальное рабочее место
- Развитие мелкой моторики у детей дошкольного возраста
- Получение нанокристаллического оксида вольфрама в гидротермальных условиях
- Люминесцентные биометки из коллоидного золота
- Совместное действие антимикробных пептидов животных на бактерии E.coli
- Разработка базового модуля сети контроля окружающей среды
- Поделки из макулатуры – моё решение экологической проблемы
- Создание мембраны для актуатора
- Сетунь вчера, Сетунь сегодня...
- Оценка выживаемости клеток при воздействии потенциальных лекарственных веществ
- Качественный анализ шоколада
- Дрон-разведчик для коммунальных служб
- Экологическое состояние почвы района «Большое Кусково» (бывший химзавод)
- Проект изготовления прибора для измерения состава воздуха на разных высотах
- Храм Покрова Пресвятой Богородицы в Медведково – уникальный шатровый храм Москвы
- Положения электрической оси сердца и ее связь с морфотипами человека
- Осторожно, БИСФЕНОЛ!
- Модель электромагнитного поезда
- Моделирование и анализ развития градостроительного планирования территории мегаполиса с помощью космического мониторинга и технологий виртуальной реальности
- Влияние географического положения на состав песка
- Оценка эффективности антидепрессивной терапии больных с аффективной патологией на основании фармакогенетического исследования
- Комбинированное энергетическое снабжение дома
- Исследование бактериальной микрофлоры рук подростков
- Создание автономной энергетической установки с использованием элемента Пельтье
- Автоматическая линия производства вязких лекарственных препаратов
- Бактериальные комплексы желудочно-кишечного тракта представителей мезофауны г. Москвы
- Интеллектуальная собственность в РФ: проблемы и перспективы развития
- Мониторинг экологического состояния среды в Москве по величине флуктуирующей асимметрии листовой пластинки березы повислой
- Извлечение соединений неодима из шлифотходов
- Художественная роль локуса «дом» в романе Э. М. Ремарка «Приют грёз»
- Технология открытия переменной звезды
- Сравнительный анализ современных многоязычных онлайн-словарей и переводчиков
- Повышение PH-среды воды, выпадающей в виде атмосферных осадков, как средство борьбы с последствиями кислотных дождей
- Изучение способности листьев к накоплению минеральных элементов
- Создание бизнес-плана строительства экоотеля
- Хедж-фонды в российской экономике
- Монилиоз. Это серьезно?
- Влияние антигололедных реагентов на состояние кожных покровов млекопитающих
- Лишайники – биоиндикаторы окружающей среды
- Габитуация и внешняя пространственная память слизевиков
- Мехатронная система выбраковки деталей
- Уровень радиации в разных районах Москвы и разработка приложения «Radiation» для мобильных устройств
- Экспресс-метод анализа при помощи образования хелатных комплексов с медью
- Мониторинг загрязнения судовыми сбросами внутренних водных путей Российской Федерации
- Зависимость роста популяции водоросли хлореллы от различных факторов
- Биоразлагаемые полимеры, или Технология d2w?
- Поилка для домашнего питомца
- Использование аддитивных технологий в авиастроении
- Направленный синтез супрамолекулярных ассоциатов на основе каркасных металлосилсесквиоксанов
- ARmuseum
- Исследование азимутально-радиальных колебаний математического маятника
- Нейронный гонщик: проектирование самообучающихся систем автопилотирования с применением машинного обучения
- Значение форм азота в сохранении вида растений-хищников
- Роботы, которые изучают космос
- Электромагнитное излучение в ПКиО 850-летия г. Москвы
- Синтез арилгидразоноциклопентадиеновых красителей для солнечных батарей
- Исследование инвазивной популяции Ротана (Percottus Glenii Dybrowski, 1877) и представляемой ей угрозы на территории звенигородской биостанции МГУ
- Визуализация адгезии CHO-клеток на носителе с помощью химерного белка TibP-PDGFR
- Подарок девочке, или Получение структур, близких к природным
- Прибор для измерения эффективности солнечных батарей
- Бактериальная биолюминесценция
- Новая земля на Новой Земле
- Особенности повреждения хвойных пород насекомыми в заказнике Звенигородской биологической станции МГУ
- Множество полусовершенных чисел и их связь с аликвотными представлениями единицы
- Школьная камера Вильсона для наблюдения мюонов
- «Умный» дом на микроконтроллере Arduino UNO
- Эквидистанты для двух точек в Московской метрике
- Использование пьезоэлектрического генератора в осветительных системах
- Исследование световых и энергетических свойств осветительных ламп
- Разработка и изготовление набора деталей для 3D-печати, для изучения робототехники
- Изучение конструкции и принципа работы высокоскоростных резистивных камер
- Учебное пособие модели ДНК для слабовидящих
- Золи на основе куркумина: синтез и исследование свойств
- Музей М.В. Ломоносова. Виртуальная версия
- Создание приложения под Android «Искатели приключений» по мультсериалу «Смешарики»
- Создание устройства дистанционного управления светом
- Разработка и изготовление модели обрабатывающей производственной линии с пневмозахватом под управлением контроллера Arduino
- Разработка методов получения силил- и борозамещенных гем-фторгалогенциклопропанов и исследование их превращений с раскрытием цикла
- Создание управляемой модели марсохода
- Разработка и изготовление модели манипулятора с функцией обучения под управлением контроллера Iskra Neo
- За границей теоремы Пифагора
- Проблема нарушения осанки в школе и меры его профилактики
- Измерение лизоцимной активности рекомбинантного белка дестабилаза-лизоцим в составе липосом
- Сравнение видового состава некоторых семейств растений московской области и острова Кипр
- Экспериментальное исследование зависимости силы сопротивления воды от скорости движения тела
- Формальное восстановительное присоединение ацетонитрила к альдегидам в присутствии пентакарбонилжелеза в качестве восстановителя
- Приуроченность жужелиц рода CARABUS к различным типам биотипов лесостепи
- Влияние токсичных «цветений» цианобактерий на организмы зообентоса в Куршском заливе Балтийского моря
- Создание модели экосистемы моря каменноугольного периода Подмосковья
- Качественное и количественное определение йодата и йодида в образцах соли
- Подарок девочке, или Получение структур, близких к природным