в московской школе
Новые синтетические производные кофермента SAM для изучения структуры метилтрансфераз
|
Работа победителя конкурса проектов и исследований «Наука для жизни» открытой городской научно-практической конференции «Наука для жизни» в секции «Органическая химия» |
Направление работы: Органическая химия
Авторы работы: ГБОУ Школа имени Маршала В.И. Чуйкова
Email: Написать
Предметы: Химия
Классы: 11 класс
Мероприятия: Конкурс проектов и исследований «Наука для жизни» открытой городской научно-практической конференции «Наука для жизни» 2021 года
|
Актуальность
Метилтрансферазы представляют собой обширную группу ферментов, катализирующих присоединение метильной группы -CH3 к различным субстратам внутри клетки. Они играют важную роль в функционировании живых систем, катализируя протекание реакций метилирования ДНК, РНК, белков и малых молекул, включая эндогенные соединения и лекарственные препараты. Источником метильной группы для реакции метилирования становится S-аденозилметионин (SAM) – молекула, содержащая в своей структуре трёхвалентную серу. Большое количество заболеваний человека связано с нарушениями в работе метилтрансфераз. Селективное управление активностью метилтрансфераз с помощью низкомолекулярных ингибиторов представляется также перспективным подходом в терапии этих заболеваний. Для этого необходимо сконструировать ингибитор, специфически блокирующий метилтрансферазу, связанную с конкретным заболеванием, не нарушив при этом работу всех остальных метилтрансфераз, ответственных за нормальное функционирование клетки. Поэтому представляется актуальной разработка нового подхода, который бы позволил облегчить исследование этого важного класса ферментов методами ЯМР, чтобы создать основу для дальнейшего рационального конструирования ингибиторов метилтрансфераз.
Цель
Разработка и проверка нового подхода к изучению метилтрансфераз методами спектроскопии ЯМР, основанного на введении спиновой метки в каталитический центр метилтрансферазы с помощью новых синтетических производных ко-фактора SAM.
Задачи
- Предложить структуры аналогов SAM, позволяющие вводить спиновую метку в активный центр метилтрансфераз.
- Разработать схему синтеза предложенных аналогов SAM.
- Синтезировать серию аналогов SAM.
- Определить способность метилтрансфераз связывать полученные аналоги SAM на примере метилтрансферазы WBSCR27.
- Проверить возможность использования полученных аналогов SAM в качестве спиновых меток для метилтрансфераз на примере белка WBSCR27.
Оснащение и оборудование, использованное при создании работы
- ЯМР-спектрометр «Bruker AVANCE»
- Спектрофотометр «Cary 50 Bio»
- Система очистки воды «MilliPore»
- pH-метр «HI 98130 Combo»
- Лиофилизатор «LabConco FreeZone 2.5»
- Лабораторная центрифуга
- Силикагель «Macherey Nagel Kieselgel 60» (0,04-0,063 мм)
Описание
В настоящей работе получены и охарактеризованы методами спектроскопии ЯМР новые соединения-аналоги SAM. Они состоят из двух функционально различных фрагментов. Первый фрагмент это SAH, являющийся структурной основой природного кофактора и обеспечивающий высокое сродство синтезируемого соединения к метилтрансферазе (МТазе). Вторая функциональная часть молекулы – фрагмент, способный хелатировать ион лантанида и прочно удерживать его в молекуле.
Основные этапы работы:
1. Синтез SAM-подобного соединения-хелатора.
2. Образование комплексов полученного соединения с лантанидами.
3. Сбор и обработка данных, полученных из ЯМР-экспериментов с белком.
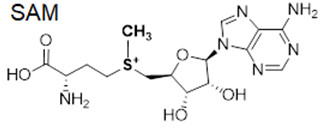
Ключевым отличием предложенных соединений от SAM является отсутствие S-метильной группы, что позволило значительно увеличить стабильность целевых соединений, поскольку трёхвалентная сера в молекуле SAM имеет тенденцию к переходу в двухвалентное состояние. Таким образом, в качестве устойчивых высокоаффинных лигандов стал синтез аналогов SAH, содержащих металл-хелатирующий заместитель в ароматическом кольце. Была реализована идея введения металлхелатирующего участка в адениновое кольцо SAH, что позволило сохранить двухвалентную серу в лиганде для обеспечения прочного связывания.
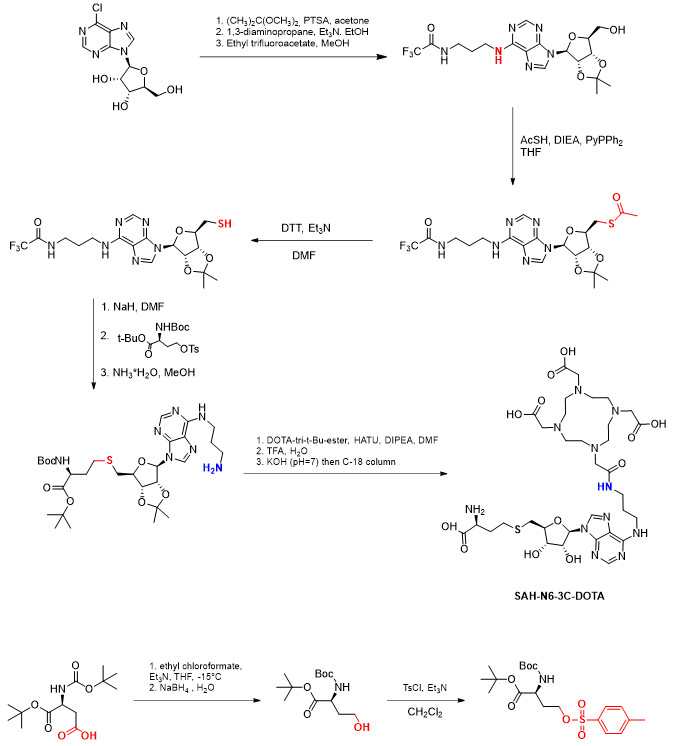
Было решено вводить заместитель в азот аминогруппы, расположенный в 6-м положении. В качестве исходного соединения было использовали коммерчески доступное 6-хлорпроизводное аденозина, которое дает возможность получить набор N6-модифицированных аналогов, различающихся длиной линкера. На первой стадии авторами был получен N6-замещенный аденозин. Следующим этапом было введение S-ацетильной группы по 5'-положению. Была проведена модификация этой реакции с использованием серии различных фосфинов. Наилучший результат с препаративной точки зрения показал дифенил-2-пиридилфосфин (PyPPh2). Этот подход позволил получить желаемое вещество в граммовых количествах.
На следующем этапе возникла необходимость S-деацилирования в присутствии N-трифторацетильной защитной группы. Авторами был разработан новый подход к снятию S-ацетильной группы дитиотреитолом, выполненный нами впервые на данном классе соединений. В разработанном способе селективное S-деацилирвоание происходит количественно в присутствии N-трифторацетильной защитной группы при комнатной температуре уже за 20 минут. Реакции присоединения аминокислотной части к 5'-SH производному аденозина в модернизированных условия в присутствии гидрида натрия дает ключевое соединение, которое является основной платформой для получения N6-производных SAH.
Первоначально было получено соединение SAH-N6-3C-NH2, содержащее лишь небольшой заместитель в ароматическом кольце. Проведение экспериментов по ЯМР-титрованию белка WBSCR27 этим соединением показало, что сайт связывания лиганда соответствует таковому при связывании SAH, причём белок находится в состоянии среднего обмена между свободной и связанной формой.
Далее получены производные SAH-N6, содержащие в качестве заместителя хелатор DOTA, а также его комплексы с парамагнитными (Tb3+, Eu3+) и диамагнитным (La3+) ионами лантанидов (SAH-N6-3C-DOTA). Измерение спектров 1Н-ЯМР подтверждает образование комплексов вследствие эффектов PRE и PSC для парамагнитных ионов.
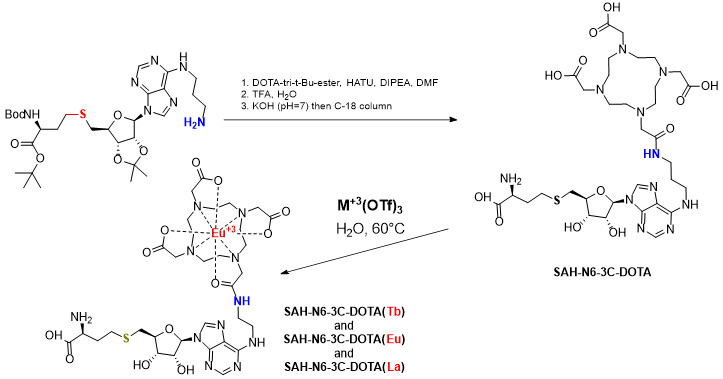
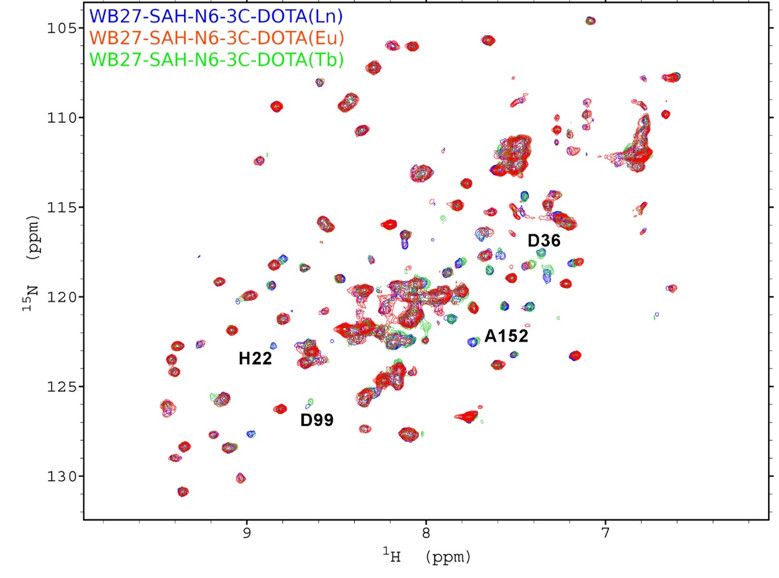
Для всех указанных соединений ряда SAH-N6 получены комплексы с WBSCR27 и измерены спектры 15N,1H-SOFAST HMQC. В спектрах наблюдались заметные эффекты PRE и PCS для сигналов амидных протонов остатков белка, формирующих центр связывания лиганда при отсутствии различий для аминокислотных остатков, удаленных от центра связывания. При этом для многих сигналов наблюдаются существенные различия в химических сдвигах при переходе от комплекса с диамагнитным La3+ к комплексам с парамагнитными ионами Eu3+ и Tb3+. Однако, даже для диамагнитного иона La3+ большинство сигналов из окружения лиганда оказываются существенно уширены и не видны на спектрах. Это уширение возникает из-за обмена между свободной и связанной с лигандом формами белка, что свидетельствует о том, что аффинность полученных соединений всё еще недостаточна для проявления эффектов, которые можно было бы использовать для структурных целей. Вместе с тем, полученные соединения могут быть успешно использованы для изучения структур МТаз, обладающих более высокой аффинностью к синтезированным лигандам. В случае же белка WBSCR27, вероятным способом повышения аффинности лигандов может стать введение заместителя не в 6-е, а в 8-е положение аденина.
Результаты работы/выводы
Впервые получены производные SAH-N6 с хелатирующим фрагментом. Строение подтверждено с помощью ЯМР и HRMS.
Проведены эксперименты по взаимодействию полученных лантанидных меток с модельной МТазой WBSCR27.
Показана способность лантанидных меток вызывать эффекты PCS и PRE в МТазе.
Перспективы использования результатов работы
Исследование полученных соединений позволило получить разнообразные данные, важные для дальнейшего изучения взаимодействия схожих молекул с метилтрансферазами, так полученные вещества могут быть полезны при изучении обширной группы метилтрансфераз, которые являются важной частью многих биохимических процессов.
Сотрудничество с вузом/учреждением при создании работы
МГУ имени М.В. Ломоносова, Факультет фундаментальной медицины, Лаборатория магнитной томографии и спектроскопии